9月10日,贝达药业埃克替尼联合化疗新辅助治疗II-IIIB期EGFR突变阳性NSCLC的前瞻性、单臂II期临床研究(NEOIPOWER)成果亮相2023世界肺癌大会(WCLC)。
摘要编号:P1.27-10
类型:壁报展示
PI:北京大学肿瘤医院 吴楠教授
研究设计
本研究是一项单臂、前瞻性Ⅱ期临床研究。
关键入组标准包括:年龄在18至75岁、EGFR突变阳性、可切除的Ⅱ-ⅢB期肺腺癌作为研究对象,至少一种可测量疾病(RECIST 1.1)、东部肿瘤协作组(ECOG)体能状态表现状态评分0~1,器官功能良好。
符合入组标准的患者将接受培美曲塞+含铂方案双药化疗,同步给予埃克替尼靶向治疗。化疗每3周为1个周期,持续2周期,埃克替尼125mg口服,每日3次,治疗持续时间为 8 周,培美曲塞500mg/m2,铂类(卡铂AUC5或顺铂75mg/m2) 。评估新辅助治疗效果,进展或出现无法耐受的毒性后重新评估是否需要手术。在最后一次埃克替尼口服后的 3-21 天内,患者将接受手术切除。
手术后,研究团队将根据患者恢复情况、影像学结果和术后病理检查,酌情给予患者辅助2周期含铂方案化疗,然后继续辅助 2-3 年埃克替尼治疗,直至疾病复发/进展、不可耐受的毒性、死亡或患者和/或由研究者决定终止治疗。
主要终点
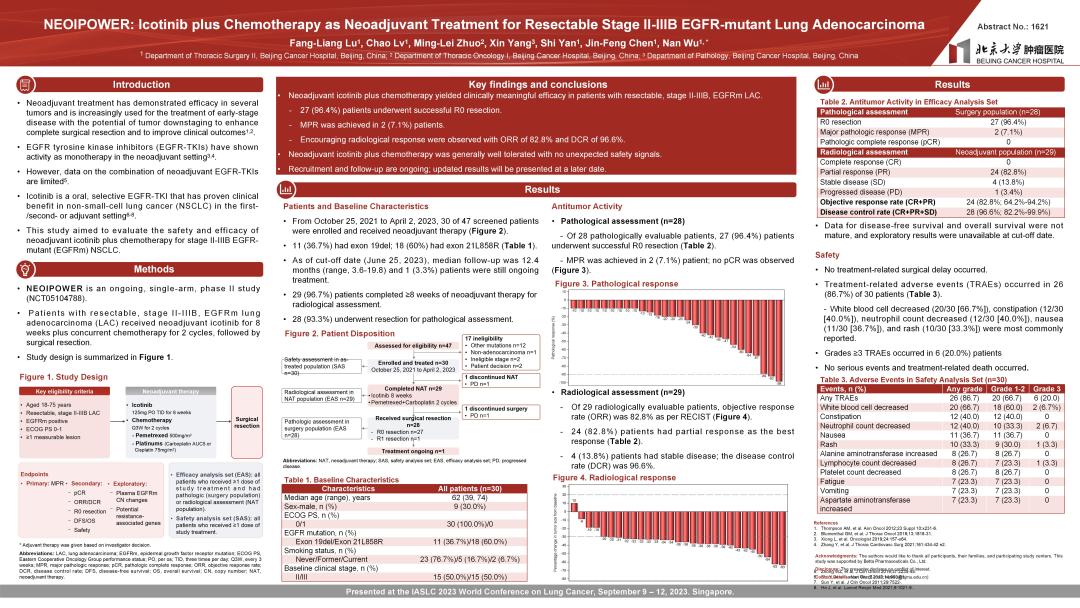
28例患者进行病理学评估,2例(7.1%)患者实现主要病理缓解(MPR)。
次要终点
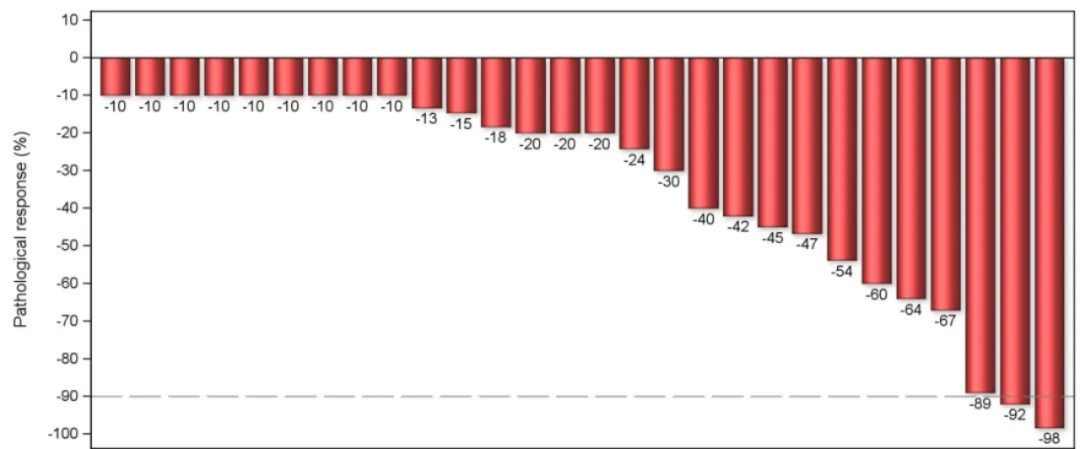
28例进行病理学评估患者中,27例(96.4%)患者成功实现R0切除。29例患者进行影像学评估,ORR为82.8%,DCR为96.6%。
研究结论
本次NEOIPOWER研究数据显示,埃克替尼联合化疗新辅助治疗对可切除的II-IIIB期EGFR突变阳性NSCLC患者具有较大的临床意义。在R0手术切除率、总体客观缓解率、疾病控制率、放射学反应和耐受性以及安全性方面,埃克替尼联合化疗新辅助治疗有较强的可行性。
贝达药业副总裁季东表示,埃克替尼是中国首个拥有术后辅助治疗适应症的一代EGFR-TKI[1],且此适应症已被纳入国家医保。本次新辅助治疗临床研究数据的公布有望为 II-IIIB 期 EGFR 突变 NSCLC 患者提供一种新的治疗方案,积累更多的循证医学证据。
参考文献
[1].https://pubmed.ncbi.nlm.nih.gov/36709117
下一条: 恩沙替尼术后辅助Ⅲ期临床研究完成II-IIIB期受试者入组
