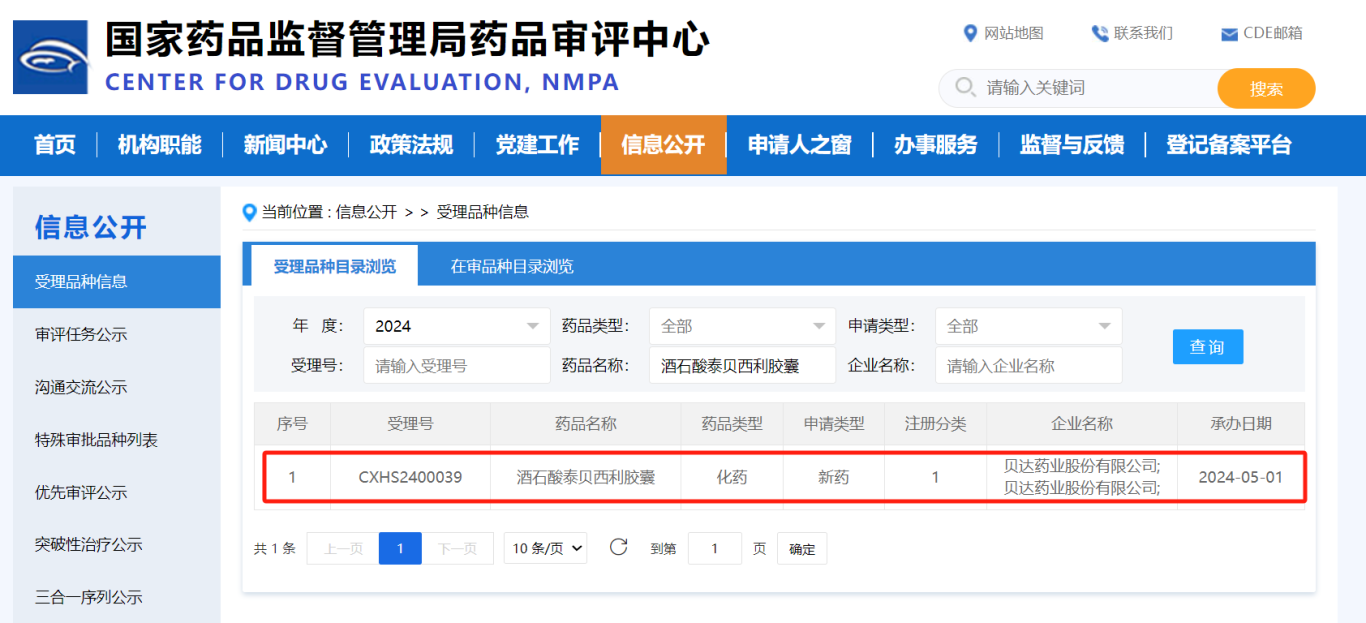
近日,贝达药业自研的康美纳上市许可申请收到国家药品监督管理局签发的《受理通知书》(受理号:CXHS2400039),适应症为“本品联合氟维司群,适用于既往接受内分泌治疗后进展的激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的局部晚期或晚期复发转移性乳腺癌患者。”
乳腺癌是发生在乳腺上皮组织的恶性肿瘤,是全球女性最常见的恶性肿瘤之一。WHO国际癌症研究机构GLOBOCAN 2020数据库研究显示,全球乳腺癌新发确诊病例预计达230万,占所有新发癌症确诊病例的11.7%,跃居第一。①2020年中国新发乳腺癌病例高达41.6万,约占全球乳腺癌新发病例18.4%;死亡病例约11.7万,约占全球乳腺癌死亡病例17.1%。②
康美纳是由贝达药业自主研发的具有全新结构的细胞周期蛋白依赖性激酶CDK4/6抑制剂。本品通过选择性抑制CDK4/6激酶的活性,抑制其下游关键信号分子Rb的磷酸化,从而抑制Rb表达阳性的肿瘤细胞增殖。在激酶水平上,酒石酸泰贝西利在CDK家族中展示出了良好的CDK4/6靶点选择性,对CDK4/6的抑制活性与阿贝西利(Abemaciclib)相当,而亚型选择性更优。
支持本次上市许可申请的关键临床研究为BTP-66732研究,这是一项多中心、随机、双盲、安慰剂对照的Ⅲ期临床研究,共计入组274例患者,评价了在既往接受内分泌治疗后进展的HR+/HER2-的局晚期、复发或转移性乳腺癌受试者中,康美纳联合氟维司群对比安慰剂联合氟维司群的有效性和安全性。主要研究终点为研究者根据RECIST v1.1标准评估的无进展生存期(PFS)。
贝达药业资深副总裁兼首席科学家王家炳博士表示:
康美纳顺利步入NDA阶段,再次彰显了贝达药业的自主研发实力,作为专注靶向抗癌新药二十年的创新药企,贝达药业将继续秉承开拓创新、造福于民的发展理念,致力于新药研发,做更多吃得起的好药,让中国老百姓活得更好。
贝达药业董事长丁列明博士表示:
康美纳是由贝达药业自主研发的、拥有完全自主知识产权的创新抗肿瘤药物,也是贝达药业在非肺癌领域的又一次成功探索。CDK4/6抑制剂已成为内分泌治疗失败的HR+/HER2-乳腺癌患者的标准治疗,期待康美纳能早日获批,为中国广大乳腺癌患者提供更多样化的治疗选择,也为中国乳腺癌慢病化事业添砖加瓦。
新闻原文及本篇引用数据来源如下:
①Hyuna S, Jacques F, Rebecca L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA CANCER J CLIN, 2021; 71:209-249
②国际癌症研究机构(International Agency for Research on Cancer)
下一条: 贝达药业EYP-1901玻璃体内植入剂临床试验申请获受理
